Estados de oxidación
se refiere a los electrones que un elemento químico gana pierde o comparte al formar un compuesto con otro átomo tan bien es un numero positivo o negativo que evidencia la capacidad que tiene un átomo para combinarse con otro
1.reglas para obtener un estado de oxidación
- El estado de oxidación de oxigeno O es -2
- El estado de H es +1
- El estado de elemento libre es 0
EJEMPLO:

opinion personal : El estado de oxidación del elemento metálico de un compuesto iónico es positivo. En los compuestos covalentes,
el número de oxidación negativo se asigna al átomo más electronegativo y todos los demás son positivos que nos sirve para hacer combinaciones.
Ley del octeto


_Enlace covalente
un enlace covalente entre dos átomos se produce cuando estos átomos se unen, para alcanzar el octeto estable compartiendo, electrones del ultimo nivel la diferencia de electronegatividad entre los átomos no es lo suficientemente grande como para que se produzca una unión de tipo ionica. para que un enlace covalente se genere es necesario que la diferencia de electronegatividad entre átomos sea menor a 1,7
de esta forma, los dos átomos comparten uno o mas pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular los enlaces covalentes se producen entre átomos de un mismo elemento no metal y entre distintos elementos no metales
Cuando átomos distintos de no metales se une una forma covalente, uno de ellos resultara mas electronegativo que el otro, por lo que tendera a atraer la nube electrónica del enlace hacia su núcleo , generando un dipolo eléctrico . esta polarización permite que las moléculas del mismo compuesto se atraigan entre si por fuerzas electrostáticas de distinta intensidad .
_Enlace metálico:
Un enlace metálico es un enlace químico que mantiene unidos los átomos y los electrones de valencia que se juntan alrededor de estos como una nube de los metales entre si,
Estos átomos se agrupan de forma muy cercana unos a otros lo que produce estructuras muy cercanas y compactas. se trata de líneas tridimensionales que adquieren estructuras tales como la típica de empaqueta miento compacto de esferas (hexagonal , compacta) cubica centrada en las caras o la cubica centrada en el cuerpo
En este tipo de estructura cada átomo metálico esta dividido por otros doce átomos ( seis en el mismo plano, tres por encima y tres por debajo) además debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales este enlace solo puede estar en sustancias en estado solido.
Los metales poseen algunas propiedades características que los diferencian de los demás materiales. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y tienen un punto de fusión alto.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica.
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones des localizados. Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad.
Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes identificados.
Fuerza intermuscular:
se refiere a las interacciones que existen en las moléculas conforme a su naturaleza generalmente la clasificación es hecha de acuerdo a la polaridad de las moléculas que están interaccionando o sobre la base de la naturaleza de las moléculas,entiéndase,de los elementos que la forman
Un enlace químico son las fuerzas que mantienen a los átomos unidos formando las moléculas, existen dos tipos de enlaces quimicos los enlaces covalentes ( en donde los átomos comparten electrones) y las interacciones débiles no covalentes (interacciones débiles entre iones , moléculas y parte de las moléculas )
Las interacciones débiles no covalentes se les llama débiles por que representan la energía que mantienen unidas a las especies moleculares y que son considerablemente mas débiles que los enlaces covalentes, las interacciones no covalentes fundamentales son :
--Enlace de hidrógeno ( antiguamente conocido como enlace por puente de hidrógeno )
opinión personal: la ley del octeto nos sirve para hacer diferentes trabajos de química y diferentes combinaciones también existen diferentes tipos de enlaces que nos ayudan a entender mejor dicha ley del octeto como los enlaces de covalente metálico e iónico que tienen diferentes combinaciones y entendimientos

opinion personal : El estado de oxidación del elemento metálico de un compuesto iónico es positivo. En los compuestos covalentes,
el número de oxidación negativo se asigna al átomo más electronegativo y todos los demás son positivos que nos sirve para hacer combinaciones.
Ley del octeto
La regla del octeto, enunciada en 1916 por Gilbert newton lewis fisicoquimico norteamericano dice la tendencia de los iones de los elementos del sistema periódico es completar sus últimos niveles
de energía con una cantidad de 8 electrones, de tal forma que adquiera una configuración muy estable y tiene diferentes enlaces tales como:

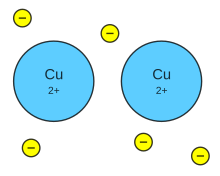
__ Enlace ionico: En química , un enlace ionico o electrovalente es la unión de átomos que resulta de la presencia de atracción electrostática entre los iones de distinto signo es decir uno fuertemente electropositivo y otro fuertemente electronegativo eso se da cuando en el enlace uno de los átomos capta electrones del otro la atracción electrostática entre los iones de carga opuesta causa que se unan y formen un compuesto químico simple, aquí no se funcionan; si no que uno da y otro recibe para que un enlace ionico es necesario que la diferencia de electronegatividades sea mas 1, siete escala de pauling.

__ Enlace ionico: En química , un enlace ionico o electrovalente es la unión de átomos que resulta de la presencia de atracción electrostática entre los iones de distinto signo es decir uno fuertemente electropositivo y otro fuertemente electronegativo eso se da cuando en el enlace uno de los átomos capta electrones del otro la atracción electrostática entre los iones de carga opuesta causa que se unan y formen un compuesto químico simple, aquí no se funcionan; si no que uno da y otro recibe para que un enlace ionico es necesario que la diferencia de electronegatividades sea mas 1, siete escala de pauling.


_Enlace covalente
un enlace covalente entre dos átomos se produce cuando estos átomos se unen, para alcanzar el octeto estable compartiendo, electrones del ultimo nivel la diferencia de electronegatividad entre los átomos no es lo suficientemente grande como para que se produzca una unión de tipo ionica. para que un enlace covalente se genere es necesario que la diferencia de electronegatividad entre átomos sea menor a 1,7
de esta forma, los dos átomos comparten uno o mas pares electrónicos en un nuevo tipo de orbital, denominado orbital molecular los enlaces covalentes se producen entre átomos de un mismo elemento no metal y entre distintos elementos no metales
Cuando átomos distintos de no metales se une una forma covalente, uno de ellos resultara mas electronegativo que el otro, por lo que tendera a atraer la nube electrónica del enlace hacia su núcleo , generando un dipolo eléctrico . esta polarización permite que las moléculas del mismo compuesto se atraigan entre si por fuerzas electrostáticas de distinta intensidad .
_Enlace metálico:
Un enlace metálico es un enlace químico que mantiene unidos los átomos y los electrones de valencia que se juntan alrededor de estos como una nube de los metales entre si,
Estos átomos se agrupan de forma muy cercana unos a otros lo que produce estructuras muy cercanas y compactas. se trata de líneas tridimensionales que adquieren estructuras tales como la típica de empaqueta miento compacto de esferas (hexagonal , compacta) cubica centrada en las caras o la cubica centrada en el cuerpo
En este tipo de estructura cada átomo metálico esta dividido por otros doce átomos ( seis en el mismo plano, tres por encima y tres por debajo) además debido a la baja electronegatividad que poseen los metales, los electrones de valencia son extraídos de sus orbitales este enlace solo puede estar en sustancias en estado solido.
Los metales poseen algunas propiedades características que los diferencian de los demás materiales. Suelen ser sólidos a temperatura ambiente, excepto el mercurio, y tienen un punto de fusión alto.
El enlace metálico es característico de los elementos metálicos. Es un enlace fuerte, primario, que se forma entre elementos de la misma especie. Al estar los átomos tan cercanos unos de otros, interaccionan sus núcleos junto con sus nubes electrónicas, empaquetándose en las tres dimensiones, por lo que quedan los núcleos rodeados de tales nubes. Estos electrones libres son los responsables de que los metales presenten una elevada conductividad eléctrica y térmica, ya que estos se pueden mover con facilidad si se ponen en contacto con una fuente eléctrica.
La vinculación metálica es la atracción electrostática entre los átomos del metal o cationes y los electrones des localizados. Esta es la razón por la cual se puede explicar un deslizamiento de capas, dando por resultado su característica maleabilidad y ductilidad.
Los átomos del metal tienen por lo menos un electrón de valencia, no comparten estos electrones con los átomos vecinos, ni pierden electrones para formar los iones. En lugar los niveles de energía externos de los átomos del metal se traslapan. Son como enlaces covalentes identificados.

Fuerza intermuscular:
se refiere a las interacciones que existen en las moléculas conforme a su naturaleza generalmente la clasificación es hecha de acuerdo a la polaridad de las moléculas que están interaccionando o sobre la base de la naturaleza de las moléculas,entiéndase,de los elementos que la forman
Un enlace químico son las fuerzas que mantienen a los átomos unidos formando las moléculas, existen dos tipos de enlaces quimicos los enlaces covalentes ( en donde los átomos comparten electrones) y las interacciones débiles no covalentes (interacciones débiles entre iones , moléculas y parte de las moléculas )
Las interacciones débiles no covalentes se les llama débiles por que representan la energía que mantienen unidas a las especies moleculares y que son considerablemente mas débiles que los enlaces covalentes, las interacciones no covalentes fundamentales son :
--Enlace de hidrógeno ( antiguamente conocido como enlace por puente de hidrógeno )
--Las fuerzas de van der wuals, que podemos clasificar a su vez en :
-ion- dipolo
-dipolo-dipolo
-dipolo-dipolo inducido
-fuerzas de dispensación de london conocidas como dipolo instantáneo-dipolo inducido
opinión personal: la ley del octeto nos sirve para hacer diferentes trabajos de química y diferentes combinaciones también existen diferentes tipos de enlaces que nos ayudan a entender mejor dicha ley del octeto como los enlaces de covalente metálico e iónico que tienen diferentes combinaciones y entendimientos

MUCHAS GRACIAS POR EL APOYO QUE SE BRINDA PARA TODOS AQUELLOS DOCENTES PREOCUPADOS POR LLEVAR INFORMACIÓN A SUS ALUMNOS, QUE EL TODO PODEROSO LES DE EXISTO
ResponderBorrar